Sebagai contoh :
Senin, 08 Oktober 2012
Pengaruh Energi Ikatan Terhadap Kestabilan Molekul
Jika suatu elemen ditambahkan pada suatu senyawa maka akan terjadi perubahan energi dalam senyawa tersebut. Hasil atau produk akan terbentuk dari reaksi tersebut. Elemen yang ditambahkan akan memutuskan ikatan dalam senyawa mulai dari bagian yang mudah untuk putus sehingga membutuhkan energi yang kecil. Jika pemutusan ikatan ini membutuhkan energi yang kecil maka senyawa tersebut akan lebih stabil.
Sebagai contoh :

Sebagai contoh :
Senin, 01 Oktober 2012
Hubungan Hibridisasi dengan Sudut Ikatan dan Panjang Ikatan
Hubungan Hibridisasi dengan Sudut Ikatan dan Panjang Ikatan
1. Atom Karbon
a. Hibridisasi sp3
Atom larbon memiliki dua orbital (2s dan 2p) untuk membentuk ikatan, artinya jika bereaksi dengan hidrogen maka akan terbentuk dua ikatan C-H. Faktanya, atom karbon membentuk empat ikatan C-H dan menghasilkan molekul metana dengan bentuk bangun ruang tetrahedron. Linus Pauling (1931) menjelaskan secara matematis bagaimana orbital s dan tiga orbital p berkombinasi atau terhibridisasi membentuk empat orbital atom yang ekuivalen dengan bentuk tetrahedral. Orbital yang berbentuk tetrahedral disebut dengan
hibridisasi sp3.
Pada posisi tereksitasi, karbon memiliki empat elektron tak berpasangan dan dapat membentuk empat ikatan dengan hidrogen. Meskipun membutuhkan energi sebesar 96 kkal/mol untuk mengeksitasi satu elektronnya terlebih dahulu, ikatan yang terbentuk dengan H (pada CH4) jauh lebih stabil dibandingkan ikatan C-H pada
molekul CH2. Ikatan C-H pd metana memiliki kekuatan ikatan 104 kkal/mol dengan panjang ikatan 1.10 A. sudut ikatan H-C-H sebesar 109.5 derajat.
b. Hibridisasi sp2; Orbital dan Struktur Etilen
Ketika kita membentuk orbital hibridisasi sp3 untuk menjelaskan ikatan dalam metana, pertama kali yang dilakukan adalah mempromosikan satu elektron dari orbital 2s ke excited state menghasilkan empat elektron tak berpasangan. Hibridisasi sp2 terjadijika satu elektron tereksitasi ke orbital p. Akibatnya, atom karbon yang terhibridisasi sp2 hanya dapat membentuk tiga ikatan sigma dan satu ikatan pi. Ikatan pi terjadi sebagai akibat dari tumpang tindih elektron pada orbital 2p-2p. Dua atom karbon sp2 dapat saling membentuk ikatan yang kuat, mereka membentuk ikatan sigma melalui overlap orbital sp2-sp2. Kombinasi ikatan sigma sp2-sp2 dan ikatan pi 2p-2p menghasilkan bentuk ikatan rangkap karbon-karbon. Bentuk bangun ruang dari
ikatan atom karbon yang terhibridisasi sp2 adalah trigonal planar.
c. Hibridisasi sp
Atom karbon memiliki kemampuan membentuk tiga macam ikatan, yaitu ikatan tunggal, rangkap dua dan rangkap tiga. Asetilena, C2H2, contoh paling sederhana dari ikatan karbon-karbon rangkap tiga. Di samping dapat berkombinasi dengan dua atau tiga orbital p, hibrida orbital 2s juga dapat berkombinasi dengan satu orbital p. Orbital sp memiliki bangun ruang linear dengan sudut ikatan HC-C sebesar 180 derajat yang telah terverifikasi dari hasil eksperimental. Panjang ikatan hidrogen-karbon sebesar 1.06A dan panjang ikatan
karbon-karbon adalah 1.20 A.
2. Atom Nitrogen
Ikatan kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atrom lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida sama dengan pada atom karbon. Sudut ikatan yang terbentuk adalah 107.3 derajat, mendekati sudut tetrahedral (109.5 derajat). Nitrogen memiliki lima elektron pada kulit terluarnya.
3. Atom Oksigen
Elektron pada ground-state atom oksigen memiliki konfigurasi:
1s2 2s2 2px2 2py1 2pz1, dan oksigen merupakan atom divalen. Dengan melihat konfigurasi elektronnya, dapat diprediksi bahwa oksigen mampu membentuk dua ikatan sigma karena pada kulit terluarnya terdapat dua elektron tak berpasangan (2py dan 2pz). Air adalah contoh senyawa yang mengandung oksigen sp3.
sudut ikatan yang terbentuk sebesar 104.5 derajat diperkirakan bahwa orbital dengan pasangan elektron bebas menekan sudut ikatan H-O-H, sehingga sudut yang terbentuk lebih kecil dari sudut ideal (109.5derajat ), seperti halnya pasangan elektron bebas dalam ammonia menekan sudut ikatan H-N-H.
4. Ikatan Alkena
dengan bahasa ikatan valensi, atom karbon terhibridisasi sp2 dan memiliki tiga orbital hibrid yang ekuivalen. Sudut ikatan yang terbentuk adalah 120 derajat satu terhadap yang lainnya. Kedua, dengan bahasa orbital molekul, interaksi antara orbital p memicu pembentukan satu orbital ikatan dan satu orbital anti ikatan pi.
5. Ikatan Alkuna
Ikatan rangkap tiga dihasilkan dari interaksi karbon-karbon yang terhibridisasi sp. Ketika dua atom karbon yang terhibridisasi sp saling berinteraksi maka akan terbentuk satu ikatan σ dan dua ikatan π. Telah diketahui bahwa sudut ikatan pada karbon yang terhibridisasi sp adalah 180 derajat, dengan demikian, asetilena C2H2, adalah molekul linear dengan sudut ikatan H-C-C sebesar 180 derajat.
Senin, 24 September 2012
Hibridisasi Kimia
HIBRIDISASI KIMIA
Hibridisasi adalah penyetaraan tingkat energi melalui penggabungan antarorbital senyawa kovalen atau kovalen koordinasi.Teori hibridisasi dipromosikan oleh kimiawan Linus Pauling dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik.
Teori hibridisasi tidaklah sepraktis teori orbital molekul dalam hal perhitungan kuantitatif. Masalah-masalah pada hibridisasi terlihat jelas pada ikatan yang melibatkan orbital d, seperti yang terdapat pada kimia koordinasi dan kimia organologam. Walaupun skema hibridisasi pada logam transisi dapat digunakan, ia umumnya tidak akurat.
Sangatlah penting untuk dicatat bahwa orbital adalah sebuah model representasi dari tingkah laku elektron-elektron dalam molekul. Dalam kasus hibridisasi yang sederhana, pendekatan ini didasarkan pada orbital-orbital atom hidrogen. Orbital-orbital yang terhibridisasikan diasumsikan sebagai gabungan dari orbital-orbital atom yang bertumpang tindih satu sama lainnya dengan proporsi yang bervariasi. Orbital-orbital hidrogen digunakan sebagai dasar skema hibridisasi karena ia adalah salah satu dari sedikit orbital yang persamaan Schrödingernya memiliki penyelesaian analitis yang diketahui. Orbital-orbital ini kemudian diasumsikan terdistorsi sedikit untuk atom-atom yang lebih berat seperti karbon, nitrogen, dan oksigen. Dengan asumsi-asumsi ini, teori hibridisasi barulah dapat diaplikasikan. Perlu dicatat bahwa kita tidak memerlukan hibridisasi untuk menjelaskan molekul, namun untuk molekul-molekul yang terdiri dari karbon, nitrogen, dan oksigen, teori hibridisasi menjadikan penjelasan strukturnya lebih mudah.
Teori hibridisasi sering digunakan dalam kimia organik, biasanya digunakan untuk menjelaskan molekul yang terdiri dari atom C, N, dan O (kadang kala juga P dan S). Penjelasannya dimulai dari bagaimana sebuah ikatan terorganisasikan dalam metana
a. Hibridisasi sp3
Hibridisasi menjelaskan atom-atom yang berikatan dari sudut pandang sebuah atom. Untuk sebuah karbon yang berkoordinasi secara tetrahedral (seperti metana, CH4), maka karbon haruslah memiliki orbital-orbital yang memiliki simetri yang tepat dengan 4 atom hidrogen.
Konfigurasi keadaan dasar karbon adalah 1s2 2s2 2px1 2py1 atau lebih mudah dilihat:
Hibridisasi menjelaskan atom-atom yang berikatan dari sudut pandang sebuah atom. Untuk sebuah karbon yang berkoordinasi secara tetrahedral (seperti metana, CH4), maka karbon haruslah memiliki orbital-orbital yang memiliki simetri yang tepat dengan 4 atom hidrogen.
Konfigurasi keadaan dasar karbon adalah 1s2 2s2 2px1 2py1 atau lebih mudah dilihat:
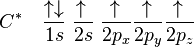
b. Hibridisasi sp2
Senyawa karbon ataupun molekul lainnya dapat dijelaskan seperti yang dijelaskan pada metana. Misalnya etilena (C2H4) yang memiliki ikatan rangkap dua di antara karbon-karbonnya.
Senyawa karbon ataupun molekul lainnya dapat dijelaskan seperti yang dijelaskan pada metana. Misalnya etilena (C2H4) yang memiliki ikatan rangkap dua di antara karbon-karbonnya.
Karbon akan melakukan hibridisasi sp2 karena orbtial-orbital hibrid hanya akan membentuk ikatan sigma dan satu ikatan pi seperti yang disyaratkan untuk ikatan rangkap dua di antara karbon-karbon. Ikatan hidrogen-karbon memiliki panjang dan kuat ikat yang sama. Hal ini sesuai dengan data percobaan.
Dalam hibridisasi sp2, orbital 2s hanya bergabung dengan dua orbital 2p:
Dalam hibridisasi sp2, orbital 2s hanya bergabung dengan dua orbital 2p:
c. Hibrid sp
Ikatan kimia dalam senyawa seperti alkuna dengan ikatan rangkap tiga dijelaskan dengan hibridisasi sp.
Dalam model ini, orbital 2s hanya bergabung dengan satu orbital-p, menghasilkan dua orbital sp dan menyisakan dua orbital p. Ikatan kimia dalam asetilena (etuna) terdiri dari tumpang tindih sp-sp antara dua atom karbon membentuk ikatan sigma, dan dua ikatan pi tambahan yang dibentuk oleh tumpang tindih p-p. Setiap karbon juga berikatan dengan hidrogen dengan tumpang tindih s-sp bersudut 180°.
Dalam model ini, orbital 2s hanya bergabung dengan satu orbital-p, menghasilkan dua orbital sp dan menyisakan dua orbital p. Ikatan kimia dalam asetilena (etuna) terdiri dari tumpang tindih sp-sp antara dua atom karbon membentuk ikatan sigma, dan dua ikatan pi tambahan yang dibentuk oleh tumpang tindih p-p. Setiap karbon juga berikatan dengan hidrogen dengan tumpang tindih s-sp bersudut 180°.
Minggu, 23 September 2012
Hibridisasi
HIBRIDISASI SP, SP2
DAN SP3
Hibridisasi
adalah penyetaraan tingkat energi melalui penggabungan antarorbital
senyawa kovalen atau kovalen koordinasi.Teori hibridisasi dipromosikan oleh kimiawan Linus Pauling dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik.
senyawa kovalen atau kovalen koordinasi.Teori hibridisasi dipromosikan oleh kimiawan Linus Pauling dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik.
Teori hibridisasi tidaklah sepraktis teori orbital molekul
dalam hal perhitungan kuantitatif. Masalah-masalah pada hibridisasi terlihat
jelas pada ikatan yang melibatkan orbital d, seperti yang terdapat pada kimia
koordinasi dan kimia organologam. Walaupun skema hibridisasi pada logam
transisi dapat digunakan, ia umumnya tidak akurat. Sangatlah penting untuk
dicatat bahwa orbital adalah sebuah model representasi dari tingkah laku
elektron-elektron dalam molekul. Dalam kasus hibridisasi yang sederhana,
pendekatan ini didasarkan pada orbital-orbital atom hidrogen. Orbital-orbital
yang terhibridisasikan diasumsikan sebagai gabungan dari orbital-orbital atom
yang bertumpang tindih satu sama lainnya dengan proporsi yang bervariasi.
Orbital-orbital hidrogen digunakan sebagai dasar skema hibridisasi karena ia
adalah salah satu dari sedikit orbital yang persamaan Schrödingernya memiliki
penyelesaian analitis yang diketahui. Orbital-orbital ini kemudian diasumsikan
terdistorsi sedikit untuk atom-atom yang lebih berat seperti karbon, nitrogen,
dan oksigen. Dengan asumsi-asumsi ini, teori hibridisasi barulah dapat
diaplikasikan. Perlu dicatat bahwa kita tidak memerlukan hibridisasi untuk
menjelaskan molekul, namun untuk molekul-molekul yang terdiri dari karbon,
nitrogen, dan oksigen, teori hibridisasi menjadikan penjelasan strukturnya
lebih mudah. Teori hibridisasi sering digunakan dalam kimia organik, biasanya
digunakan untuk menjelaskan molekul yang terdiri dari atom C, N, dan O (kadang
kala juga P dan S). Penjelasannya dimulai dari bagaimana sebuah ikatan
terorganisasi dalam metana.
a. Hibridisasi SP3
Hibridisasi
menjelaskan atom-atom yang berikatan dari sudut pandang sebuah atom. Untuk
sebuah karbon yang berkoordinasi secara tetrahedral (seperti metana, CH4),
maka karbon haruslah memiliki orbital-orbital yang memiliki simetri yang tepat
dengan 4 atom hidrogen.
Konfigurasi keadaan dasar karbon adalah 1s2 2s2 2px1 2py1 atau lebih mudah dilihat:
Konfigurasi keadaan dasar karbon adalah 1s2 2s2 2px1 2py1 atau lebih mudah dilihat:
(Perhatikan bahwa
orbital 1s memiliki energi lebih rendah dari orbital 2s, dan orbital 2s
berenergi sedikit lebih rendah dari orbital-orbital 2p). Teori ikatan valensi
memprediksikan, berdasarkan pada keberadaan dua orbital p yang terisi setengah,
bahwa C akan membentuk dua ikatan kovalen, yaitu CH2. Namun, metilena adalah
molekul yang sangat reaktif (lihat pula: karena), sehingga teori ikatan valensi
saja tidak cukup untuk menjelaskan keberadaan CH4. Lebih lanjut
lagi, orbital-orbital keadaan dasar tidak bisa digunakan untuk berikatan dalam
CH4. Walaupun eksitasi elektron 2s ke orbital 2p secara teori
mengijinkan empat ikatan dan sesuai dengan teori ikatan valensi (adalah benar
untuk O2), hal ini berarti akan ada beberapa ikatan CH4 yang
memiliki energi ikat yang berbeda oleh karena perbedaan aras tumpang tindih
orbital. Gagasan ini telah dibuktikan salah secara eksperimen, setiap hidrogen
pada CH4 dapat dilepaskan dari karbon dengan energi yang sama. Untuk
menjelaskan keberadaan molekul CH4 ini, maka teori hibridisasi
digunakan. Langkah awal hibridisasi adalah eksitasi dari satu (atau lebih elektron).
Proton yang
membentuk inti atom hidrogen akan menarik salah satu elektron valensi karbon.
Hal ini menyebabkan eksitasi, memindahkan elektron 2s ke orbital 2p. Hal ini
meningkatkan pengaruh inti atom terhadap electron-elektron valensi dengan
meningkatkan potensial inti efektif. Kombinasi gaya-gaya ini membentuk
fungsi-fungsi matematika yang baru yang dikenal sebagai orbital hibrid. Dalam
kasus atom karbon yang berikatan dengan empat hidrogen, orbital 2s (orbital
inti hampir tidak pernah terlibat dalam ikatan) "bergabung" dengan
tiga orbital 2p membentuk hybrid sp3 (dibaca : hybrid s-p-tiga)
menjadi :
Pada CH4, empat
orbital hibrid sp3 bertumpang tindih dengan orbital 1s hidrogen, menghasilkan
empat ikatan sigma. Empat ikatan ini memiliki panjang dan kuat ikat yang sama,
sehingga sesuai dengan pengamatan.
Sebuah pandangan
alternatifnya adalah dengan memandang karbon sebagai anion C4−.
Dalam kasus ini, semua orbital karbon terisi :
Jika kita merekombinasi
orbital-orbital ini dengan orbital-s 4 hidrogen (4 proton, H+) dan
mengijinkan pemisahan maksimum antara 4 hidrogen (yakni tetrahedal), maka kita
bisa melihat bahwa pada setiap orientasi orbital-orbital p, sebuah hidrogen
tunggal akan bertumpang tindih sebesar 25% dengan orbital-s C dan 75% dengan
tiga orbital-p C. HaL ini sama dengan persentase relatif antara s dan p dari
orbital hibrid sp3 (25% s dan
75% p). Menurut teori hibridisasi orbital, elektron-elektron valensi metana
seharusnya memiliki tingkat energi yang sama, namun spektrum fotoelekronnya [3]
menunjukkan bahwa terdapat dua pita, satu pada 12,7 eV (satu pasangan elektron)
dan satu pada 23 eV (tiga pasangan elektron). Ketidakkonsistenan ini dapat
dijelaskan apabila kita menganggap adanya penggabungan orbital tambahan yang
terjadi ketika orbital-orbital sp3 bergabung dengan 4 orbital hidrogen.
b. Hibridisasi SP2
Senyawa karbon
ataupun molekul lainnya dapat dijelaskan seperti yang dijelaskan pada metana.
Misalnya etilena (C2H4) yang memiliki ikatan rangkap dua
di antara karbon-karbonnya. Struktur Kekule metilena akan tampak seperti :
Karbon akan
melakukan hibridisasi sp2 karena orbtial-orbital hibrid hanya akan membentuk
ikatan sigma dan satu ikatan pi seperti yang disyaratkan untuk ikatan rangkap
dua di antara karbon-karbon. Ikatan hidrogen-karbon memiliki panjang dan kuat
ikat yang sama. Hal ini sesuai dengan data percobaan. Dalam hibridisasi sp2
, orbital 2s hanya bergabung dengan 2 orbital 2p :
membentuk 3 orbital
sp2 dengan satu orbital p tersisa. Dalam etilena, dua atom karbon
membentuk sebuah ikatan sigma dengan bertumpang tindih dengan dua orbital sp2
karbon lainnya dan setiap karbon membentuk dua ikatan kovalen dengan hidrogen
dengan tumpang tindih s-sp2 yang bersudut 120°. Ikatan pi antara
atom karbon tegak lurus dengan bidang molekul dan dibentuk oleh tumpang tindih
2p-2p (namun, ikatan phi boleh terjadi boleh tidak). Jumlah huruf p tidaklah
seperlunya terbatas pada bilangan bulat, yakni hibridisasi seperti sp2.5 juga
dapat terjadi. Dalam kasus ini, geometri orbital terdistorsi dari yang
seharusnya. Sebagai contoh, seperti yang dinyatakan dalam kaidah Bent, sebuah
ikatan cenderung untuk memiliki huruf-p yang lebih banyak ketika ditujukan ke substituen
yang lebih elektronegatif.
c. Hibridisasi SP
Ikatan kimia dalam
senyawa seperti alkuna dengan ikatan rangkap tiga dijelaskan dengan hibridisasi
sp.
Dalam model ini, orbital
2s hanya bergabung dengan satu orbital-p, menghasilkan dua orbital sp dan
menyisakan dua orbital p. Ikatan kimia dalam asetilena (etuna) terdiri dari
tumpang tindih sp-sp antara dua atom karbon membentuk ikatan sigma, dan dua
ikatan pi tambahan yang dibentuk oleh tumpang tindih p-p. Setiap karbon juga
berikatan dengan hidrogen dengan tumpang tindih s-sp bersudut 180°.
Langganan:
Komentar (Atom)








